原标题:深度解码专利链接:创新药企、仿制药企你们准备好了吗?
背景回顾
2017年10月8日,中共中央办公厅、国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》),引发了知识产权、医药、投资机构、法律界的一波大讨论。
国家知识产权局条法司专家邱福恩在“钨石生物医药知识产权峰会”上就此发表了题为《药品专利链接制度介绍及几点思考》的主题演讲,从立法本义和实施效果评价两方面进行了剖析。以下是演讲内容文字记录稿(经修订):
《意见》的15-19条给出了药品专利链接制度的整体框架设计,未来还将进一步细化具体的制度设计。该意见中第16项明确提出要探索建立药品专利链接制度,这是我国首次明确提出要建立专利链接制度。以下对相关制度的介绍和解读均仅代表个人观点。
制度介绍
专利链接制度的历史沿革
药品专利链接制度起源于美国。1984年,美国通过了著名的Hatch-Waxman法案,该法案包括ANDA(简略新药申请)、药品专利链接制度、药品专利保护期补偿、Bolar例外、数据保护等几个方面。
此后,加拿大、澳大利亚、韩国等国家通过与美国签定自由贸易协定,相继引入了专利链接制度,但欧盟、瑞士、日本、印度至今尚未建立这样的制度。
美国链接制度流程
美国链接制度从整体上可以分为4大块:桔皮书制度、专利声明制度、遏制期制度、首仿药市场独占期制度。
首先来看桔皮书制度。这一制度要求原研药企业在申请药品上市时需要提交专利信息,在原研药上市之后,FDA(美国食品药品监督管理局)会将相关专利信息登记在桔皮书中。桔皮书的信息提供了专利链接制度的基础。12月28日,食品药品监督管理总局发布了我国第一批上市药品目录集,类似于美国的桔皮书,在目录集后的附录里收录了药品相关专利。
仿制药提出申请时,就要针对桔皮书里面列出的每一个专利,做出专利声明。美国的专利声明可以划分称为两大类,第一大类就是我们通常所谓的certification,另外一大类包括两个statement。
通常certification包括四小类:第I段声明是,桔皮书里面没有列出相关专利;第II段声明是,桔皮书所列出的专利已经过期;第III段声明是,桔皮书所列的专利过期前仿制药不会上市;第IV段声明是最重要、最核心的一类声明,即声明桔皮书所列的专利无效、不可实施或者生产上市仿制药不会侵犯专利权,也就是我们通常所称的“专利挑战”。
再看那两个statement。第一个statement也称为小viii项声明,针对的是药品使用方法专利。如果一个原研药有多个适应症,只有部分适应症是受专利保护的情况下,仿制药企业可以在其仿制药上市申请中将受到专利保护的适应症删除,即不寻求获得批准受专利保护的适应症,那这个仿制药就不会侵犯该使用方法专利,这个时候可以作出这样的声明。第二种statement是没有专利的声明,可以声明说没有专利。
无专利statement和第I段certification有什么区别呢?根据FDA的解释,如果作出的是无专利statement,就是指仿制药申请人认为不存在相关专利;而提出第I段certification则是指仿制药申请人认为存在相关专利,但是在桔皮书中没有列出。
收到仿制药申请人的专利声明之后,FDA会根据不同的声明做出相应的处理。如果提出的是第I、II段声明、以及无专利的第viii项声明的情况下,FDA会直接批准;如果提出的是第III段声明,FDA会在专利到期后批准;如果仿制药企业提出的是第IV段声明(专利挑战),则仿制药企业需要通知专利权人及原研药企业,专利权人在收到通知之后45天之内可以起诉,起诉的话就进入了一个非常重要的程序---遏制期,这个时候FDA会中止审批长达30个月,但是不会停止接受审评,中止审批的目的是等待法院解决专利侵权纠纷。如果在30个月以内,法院判定专利权人胜诉,也就是仿制药侵犯专利权,那么仿制药不能直接获得审批,一般会要求仿制药申请人修改声明,即需要等到专利过期之后才能获得上市许可。如果专利挑战成功了,也就是仿制药企业胜诉,在判决做出后,FDA会直接审批上市。如果等到了30个月,诉讼仍未解决,那么FDA也会批准仿制药上市。这就是整个链接制度的流程。
此外,还有一个非常重要的制度---首仿药的市场独占期制度,指的是首个提交专利挑战的仿制药企业可以获得180天的市场独占期。
实际上,我们国家的链接制度的整体框架设计和美国的框架是一样的,虽然还有许多地方需要进一步细化。
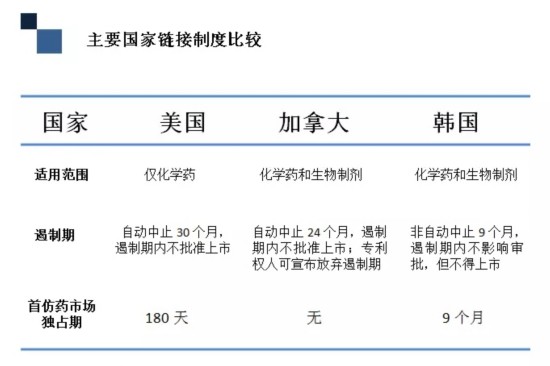
主要国家链接制度比较
从制度框架上来看,美国、加拿大、韩国的链接制度基本一样,只是细节上存在区别。第一个较大的区别是适用范围,美国的链接制度只适用于化学药,而加拿大、韩国除了化学药外还适用于生物制剂。第二个区别是遏制期不同,美国的遏制期长达30个月,加拿大是24个月,韩国9个月。值得注意的是,在加拿大的专利链接制度中,专利权人可以放弃遏制,后面会讲到在什么情况下会选择放弃。第三个区别是首仿药市场独占期,美国为180天,加拿大没有独占期,韩国是9个月。
既然美国的生物类似物不适用于专利链接制度,那生物类似物上市遵循怎样的流程呢?美国有一套独特的制度叫“专利舞蹈”(Patent Dance)。这项制度是通过2009年《生物制品价格竞争和创新法案》所建立的一套制度,2010年生效。这项制度非常有意思,它要求在生物类似物上市申请受理之后,上市申请人和参比制剂企业 (PRS)通过一系列的程序,互相交换信息,交换专利清单,对所涉及的专利进行协商,以就专利清单达成一致。
从上图可以看到,申请人走一步,PRS走一步,申请人再走一步,PRS再走一步,这样一来一回,非常像两个人在跳舞,所以被称为“专利舞蹈”。在跳完这场舞之后,专利权人就可以可以开始第一阶段诉讼。但与链接制度有很大区别的是,尽管专利权人可以在生物类似物上市审批期间提起第一阶段诉讼,但是诉讼不影响生物类似物的上市审批。接着从生物类似物企业计划上市销售生物类似物这个时点往前推180天,申请人需要发出上市通知,PRS在收到上市通知之后,可以开始第二阶段诉讼,期间可以请求临时禁令。
【关闭】